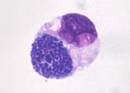
Anaplasmen
Anaplasma phagocytophilum (Ap) ist ein durch Schildzecken (z.B. Ixodes ricinus, „Gemeiner Holzbock“) übertragenes Bakterium, welches auf Grund seines Zellwandaufbaus den gramnegativen Bakterien zugeordnet wird. In Säugetieren vermehrt sich der Infektionserreger obligat intrazellulär, vorwiegend in neutrophilen Granulozyten. In diesen Zellen sind Ap-Organismen als Morulae – eine Zusammenlagerung mehrerer Bakterien – nach Giemsa-Färbung lichtmikroskopisch sichtbar. Als Wirte fungieren neben Hunden auch Menschen, andere Haus- und Nutztiere, Wildtiere und Nager. Im Hund kann Ap die canine granulozytäre Anaplasmose auslösen, die sich vor allem durch unspezifische klinische Veränderungen wie Fieber, Abgeschlagenheit und Lahmheiten äußert. Der klinische Verlauf ist unterschiedlich schwer ausgeprägt und nach bisherigen Erkenntnissen verläuft die Infektion meist subklinisch. Nach der Infektion verbleibt der Erreger im Wirt (persistierende Infektion).
Derzeitige Projekte der Arbeitsgruppe:
- Isolierung und Kultivierung von Ap
Ap ist in Zelllinien der Vektoren kultivierbar (z.B. in Zellen verschiedener Ixodes-Arten). Ap wird dabei aus dem Blut der infizierten Haus- und Nutztieren isoliert und propagiert. Ziel ist es, die isolierten Stämme mittels massenspektrometrischen und DNA-basierten Technologien genauer zu charakterisieren.
- Erreger-Wirt Interaktion
Im Säugetierwirt infiziert Ap neben neutrophilen Granulozyten auch Endothelzellen. Mikrovaskuläre Endothelzellen scheinen für die anfängliche Etablierung des Erregers im Säugertierwirt eine entscheidende Rolle zu spielen. Ziel ist es, in einem in vitro Infektionsmodel die Interaktion zwischen Ap und den Wirtszellen, insbesondere den Endothelzellen detailliert zu charakterisieren.
- Entwicklung eines Mikroarray zum schnellen Nachweises von Zecken-übertragenen Infektionserregern
Die Zecke Ixodes ricinus ist oft Träger mehrerer Infektionserreger. Dadurch ist die gleichzeitige Übertragung verschiedener Mikroorganismen auf den Wirt während der mehrtägigen Blutmahlzeit der Zecke grundsätzlich möglich. Wie sich nun die gleichzeitig im Wirt befindenden Infektionserreger gegenseitig beeinflussen und sich diese Koinfektionen auf den Krankheitsverlauf auswirken, ist wenig erforscht. In Hinblick auf diese Mehrfachinfektion wäre es deshalb von Vorteil, ein großes Spektrum dieser Infektionserreger in einer einzelnen Analyse nachweisen zu können. Die auf molekularer Basis beruhende Microarray-Technik erlaubt es, Vertreter der Gattungen Anaplasma, Babesia, Borrelia und Rickettsia in einem Untersuchungsgang zu erkennen. Vorbereitend werden für diese Untersuchung zunächst mit Hilfe einer speziellen Polymerase-Kettenreaktion (multiplex PCR) ausgewählte Nukleinsäureabschnitte (DNA) der Erreger vervielfältigt. Danach binden diese PCR-Produkte an speziell entworfene DNA-Sonden auf einem Mikroarray, wobei durch eine Färbereaktion die positiven Ergebnisse sichtbar gemacht werden.